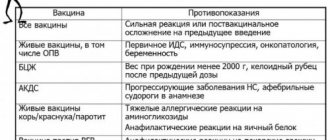
Показания для вакцинации «Ваксигрип»
Вакцинация рекомендуется всем лицам и, прежде всего, тем, кто подвергается повышенному риску заболевания гриппом, особенно, если грипп присоединяется к уже имеющимся у человека заболеваниям:
- Маленькие дети (младше 1 года)
- Дети посещающие детский сад, школу, спортивные и детские секции, кружки.
- Взрослые люди старше 65 лет.
- Люди с хроническими заболеваниями органов дыхания, включая бронхиальную астму, почечную недостаточность, гемоглобинопатии и иммунодефицитные состояния.
- Больные сердечнососудистыми заболеваниями.
- Больные хронической почечной недостаточностью.
- Больные с хроническими нарушениями метаболизма, включая сахарный диабет.
- Дети и взрослые с иммунодефицитными состояниями, больные, получающие иммунодепрессанты, цитостатики, лучевую терапию или высокие дозы кортикостероидов.
- Дети и подростки от 6 мес. до 18 лет, в течение длительного времени получающие препараты, содержащие ацетилсалициловую кислоту, и, следовательно, подверженные повышенному риску развития синдрома Рея вследствие гриппозной инфекции.
- Медицинский персонал, учителя, врачи, водители общественного транспорта: все те, кто ежедневно контактирует с большим количеством людей, а также члены их семей.
Вакцинация от гриппа
Большинство людей взаимодействуют друг с другом в коллективах. Дети посещают детский садик, школу, колледжи и ВУЗы, а взрослые ходят на работу. В период подъема заболеваемости гриппом одним из важных критериев подготовленности к этому явлению является величина иммунной прослойки. Иммунная прослойка – количество человек в коллективе (%), привитых от гриппа. Любой человек (взрослый или ребенок), привитый от гриппа, – барьер на пути распространения вируса. Если заразившийся человек попадает в коллектив, то чем больше привитых в этом коллективе, тем меньше вероятность лавинообразного распространения заболевания. Следовательно, чем выше процент привитых в коллективе, тем меньше путей передачи вируса. Как показывают исследования, в коллективе, где иммунная прослойка стремится к 100%, заболеваемость гриппом снижается в 12 раз, 50% – в 4.5 раза.
Необходимо учитывать сроки формирования иммунитета после вакцинации. Очень важно вакцинироваться заблаговременно, чтобы к моменту подъема заболеваемости вы и ваши дети были полностью защищены. Период октябрь-ноябрь традиционно характеризуется увеличением частоты ОРЗ. Люди начинают болеть респираторными инфекциями, женщинам часто приходится брать больничный лист по уходу за ребенком. Проявления ринита или подъем температуры выше 37 градусов расценивается врачами как противопоказание к вакцинации. Прививаться в этот период очень сложно. Поэтому для создания максимальной иммунной прослойки в коллективе (в школе, детском саду, на работе) рекомендуется прививаться в более ранние сроки, а именно – в сентябре.
Вакцинация в сентябре даёт следующие преимущества, которые связаны друг с другом:
- Практически нет простудных заболеваний (ОРЗ)
- Мамы не берут больничный лист по уходу за ребенком
- Нет противопоказаний к вакцинации (ринит, незначительный подъем температуры)
- Иммунитет формируется через 14 дней после вакцинации, и уже к октябрю привитый человек (взрослый или ребенок) имеет сформированную противовирусную защиту
Вакцинация – это возможность избежать гриппа и серьезных осложнений, которые сопутствуют инфекции. Вакцинация также способствует снижению финансовых потерь, выраженных в сокращении дохода за период утраты работоспособности и уменьшении затрат, связанных с лечением. И самый важный момент: если Вы привиты, Вы не принесете вирус гриппа в свой дом и не станете причиной болезни близких. Ранняя вакцинация позволяет создать все условия для максимальной защиты коллектива в период подъема заболеваемости гриппом.
Противопоказания
Только врач может решить, подходит ли Ваксигрип для вакцинации
Ваксигрип противопоказан при наличии в анамнезе аллергической реакции на любой компонент вакцины.
Проведение вакцинации Ваксигрип противопоказано в следующих случаях:
- Если у ребенка или взрослого аллергия (гиперчувствительность) к активным веществам вакцины или любых из ингредиентов – яичные белки или куриные белки, неомицин, формальдегид или октоксинол-9.
- Если у ребенка заболевание с высокой или умеренной температурой или острой инфекцией.
Возможные побочные эффекты
При проведении вакцинации могут наблюдаться следующие побочные реакции: головная боль, потливость, миалгия, артралгия, повышение температуры тела, недомогание, озноб, утомляемость, головокружение, бессонница, рвота, лихорадка. Местные реакции могут включать: покраснение, припухлость, болезненность, уплотнение, экхимозы. Реакции обычно проходят в течение 1-2 дней и не требуют лечения.
Приходите на прививки в «ЧудоДети». Полный спектр вакцин для детей и взрослых, семейная вакцинация — по специальной цене!
«ЭпиВакКорона» защищает от коронавируса. Или нет
Долгожданное событие: результаты фазы 1-2 клинических испытаний вакцины «ЭпиВакКорона» против COVID-19, разработанной ГНЦ ВиБ «Вектор» Роспотребнадзора, опубликовал журнал «Инфекция и иммунитет». Журнал намного менее престижный, чем The Lancet, в котором публиковались разработчики Гам-КОВИД-Вак. Двухлетний импакт-фактор по РИНЦ для «Инфекции и иммунитет» — 0,775.
Так или иначе, теперь есть более подробная информация о вакцине: детальное описание подбора участников, критериев включения, порядка вакцинации, побочных эффектов (очень незначительных). И главное — особенности гуморального ответа, то есть выработка антител.
Из чего сделана вакцина
До сих пор источниками информации были интервью сотрудников «Вектора»и в СМИ, описания изобретений к патентам ( , , ), а также ответы разработчиков на вопросы участников КИ: в и . Из патентов удалось узнать, какие именно участки аминокислотной последовательности S-белка выбраны для испытаний на животных и затем для «человеческой» вакцины: тайны в этом вроде бы нет, но это нигде не озвучивалось.
В описании к патенту № названы участки S454-477, S1179-1200, S1189-1209, то есть один пептид из рецепторсвязывающего домена RBD субъединицы S1 и два перекрывающихся — из субъединицы S2. Числа — это номера аминокислот в S-белке коронавируса, том самом, который в виде тримера образует «шипы» вируса и связывается с клеточным рецептором ACE2.
Специалисты, не участвовавшие в разработке, задавались вопросом, как были выбраны эти пептиды и почему именно они
. Детального ответа на него в публикации нет. Сказано, что использовался «дизайн
insilico
пептидных фрагментов, представляющих известные вирусные антигены» и самые эффективные комбинации были отобраны в экспериментах на животных. Сказано также, что учитывались данные о хорошо изученном S-белке SARS-CoV-1; напомним, что разработка вакцины была начата год назад, когда о новом коронавирусе знали намного меньше, чем сейчас. Исключались эпитопы, связанные с возможным антителозависимым усилением инфекции, а также эпитопы, сходные с участками белков человека. (Антителозависимое усиление инфекции — редкое явление, когда антитело, связываясь с вирусом, способствует не его уничтожению, а его проникновению в иммунные клетки. Признаки АЗУИ наблюдали в экспериментальных условиях для других коронавирусов, и многие опасались, что оно возможно и для SARS-CoV-2.) Также отдавали предпочтение наиболее консервативным участкам белка, которые с наименьшей вероятностью будут затронуты мутациями.
Связывание антитела с рецепторсвязывающим доменом, конечно, может помешать вирусу взаимодействовать с клеткой (хотя не все эпитопы в рецепторсвязывающем домене RBD являются нейтрализующими). Роль эпитопов из S2 («ножки» S-белка) не вполне ясна, возможно, связывание антител с этими участками препятствует слиянию мембран вируса и клетки. Но с пептидами S1179-1200, S1189-1209 есть еще одна сложность: они содержат сайт гликозилирования, то есть аминокислоту, к которой в белке вируса прикреплена углеводная цепочка. На синтетическом пептиде в составе вакцины его, естественно, нет, отсюда вопрос: будут ли антитела к пептиду с сайтом гликозилирования, но без углевода корректно распознавать вирусный белок.
Чтобы быть иммуногенной, молекула должна быть достаточно большой, поэтому короткий пептид ковалентно присоединяют к белку-носителю. Эту конструкцию сорбируют на адъювант (гидроксид алюминия). В экспериментах на животных роль белка-носителя выполнял гемоцианин лимфы моллюска (KLH) — мощный активатор Т-хелперных клеток, хорошо известный иммуностимулирующими свойствами. Он входил в состав вакцины «ЭпиВакЭбола». Однако в вакцине «ЭпиВакКорона» использовали другой белок-носитель
— химерный белок, наработанный в кишечной палочке, который включает полную последовательность нуклеокапсида (N-белка) SARS-CoV-2.
Заведующий отделом зоонозных инфекций и гриппа ФБУН ГНЦ ВБ «Вектор» Александр Рыжиков сказал на встрече с инициативной группой участников КИ, что этот выбор был обусловлен высокой стоимостью гемоцианина, и кроме того, N-белок — «бесценный источник большого количества Т-хелперных эпитопов коронавируса». В то же время не исключено, что замена носителя привела к более низким титрам антител у людей по сравнению с теми титрами, что были получены в экспериментах на животных (действительно очень высокими).
«Я не вижу мягкого выхода из сложившейся ситуации»
О защитной эффективности, то есть влиянии вакцины на вероятность заболеть COVID-19, количественных данных пока нет. Фаза 1-2 КИ была начата в июле 2021 года и завершится 18 мая 2021 года, тогда, очевидно, будут окончательные данные о доле заболевших среди вакцинированных и среди получивших плацебо. В статье сообщается об одном вакцинированном, заболевшем COVID-19, и одном в группе плацебо. Однако 100 человек, из которых 43 получили плацебо, а остальные вакцину, — это в любом случае мало для достоверной статистики. Промежуточный ответ по пострегистрационным испытаниям, в которых принимают участие 3000 человек, будет подготовлен не позднее середины апреля, заявил Владимир Петров, заведующий информационно-аналитическим отделом ГНЦ ВиБ «Вектор».
Иммунный ответ на вакцину «ЭпиВакКорона», то есть появление антител и клеточного ответа у вакцинированных, обсуждается с начала года. В январе пресс-служба Роспотребнадзора , что «по результатам 1-2 фаз клинических испытаний иммунологическая эффективность вакцины «ЭпиВакКорона» составляет 100%». Подчеркивалось, что выявлять иммунный ответ нужно с помощью специального теста, в котором антитела взаимодействуют не с полноразмерным S-белком коронавируса, как в большинстве коммерческих тестов, а с пептидами, подобными тем, что входят в состав вакцины. Это вызвало новый вопрос: если так, то будут ли антитела, возникшие после прививки «ЭпиВакКороной», взаимодействовать c S-белком реального вируса?
Участники КИ, разочарованные отсутствием информации, начали проводить собственное исследование . Ранее на этой неделе они опубликовали открытое письмо, в котором говорилось, что среди вакцинированных есть заболевшие, в том числе госпитализированные, и что «120 участников III фазы клинических исследований и 19 вакцинированных в рамках гражданской вакцинации сдали анализ на антитела тест-системой, рекомендованной Роспотребнадзором. У 30% антитела обнаружены не были (для участников клинических исследований сделана поправка на плацебо)».
Более того: защитная эффективность в значительной мере определяется нейтрализующими антителами. В экспериментах, организованных инициативной группой, не удалось обнаружить нейтрализующей активности ни в одном из десятков образцов сыворотки вакцинированных. Реакцию нейтрализации проводили в нескольких лабораториях. На сайте epivakorona.com подробно описаны результаты, которые получил д.б.н. Александр Чепурнов, ведущий научный сотрудник ФИЦ фундаментальной и трансляционной медицины СО РАН, ранее заведующий лабораторией особо опасных инфекций «Вектора». Александр Чепурнов имеет опыт работы с SARS-CoV-2 и часто дает комментарии для СМИ. Он также является автором научно-популярной книги «Вирусолог: цена ошибки» о вирусе Марбург.
А дальше самое интересное. Эти результаты прямо противоречат данным, представленным в статье. В первой фазе, напомним, участвовало 14 человек, во второй — 86, но половина получила плацебо. Из 57 вакцинированных антитела появились у всех. И не только к антигенам вакцины, но и к полноразмерному вирусу SARS-CoV-2, инактивированному бета-пропиолактоном. Нейтрализующая активность также наблюдалась у всех вакцинированных, разброс титров от 1:20 до 1:160. В публикации разработчиков подробно описан метод определения титров нейтрализующих антител: в текст включены мелкие детали, которые обычно помещают в приложения, вплоть до числа промываний лунок с клетками.
Как такое могло произойти? Хорошо известно, что абсолютные значения нейтрализующих титров, полученных в разных лабораториях, сравнивать трудно. Различаются условия реакции нейтрализации, методы детекции поражения клеток, сами критерии «нейтрализующего титра»: например, нейтрализующим может называться максимальное разведение сыворотки крови человека, при котором вирус не сможет заразить клетки в культуре, или такое разведение, при котором число инфицированных клеток уменьшится вдвое. Но различие между «антитела есть у всех» и «нет ни у кого» слишком велико для методических нюансов.
На вопрос отвечает Андрей Криницкий
, генеральный директор компании и основатель проекта epivakorona.com.
«Есть случаи, в которых конкретная технология роли не играет. В данной ситуации либо кто-то совершил ошибку (многократную) при эксперименте, либо врет.
Александр Чепурнов ошибку совершить не мог, так как в эксперименте есть «контроли» (образцы от вакцинированных Спутником V либо переболевших, причем исследователи не знали, какие образцы кому принадлежат. — PCR.NEWS
). Эксперимент повторяли многократно в той же лаборатории. И такие же точно данные были получены в двух других независимых лабораториях. С учетом большого резонанса и общественной важности мы на всякий случай повторим эксперимент Чепурнова еще раз, уже в Москве. Это будет уже пятая такая проверка и вторая по нашей инициативе.
Я не вижу красивого и мягкого выхода из сложившейся ситуации — у двух сторон диаметрально противоположный результат эксперимента. Значит, точно как минимум у одной из двух сторон все очень плохо. Пока мы не найдем лабораторию, которая осмелится открыто и официально опубликовать результаты такого эксперимента, я могу лишь просить влиятельных лиц точно так же, как мы, в частном порядке заказывать повтор эксперимента и действовать, исходя из его результатов. Не нужно верить на слово «Вектору», не нужно верить нам — повторите и посмотрите сами. Вопрос жизни и смерти многих людей, оно того правда стоит».
В заключительной части статьи разработчиков вакцины говорится, что «высокие титры вирус-специфических антител не обязательно ассоциированы с защитой от COVID-19». Авторы отмечают, что N-белок в составе вакцины, хотя и не бывает мишенью нейтрализующих антител, в отличие от S-белка, но может способствовать появлению вирус-специфических Т- и В-клеток памяти, причем Т-клетки памяти могут сохраняться дольше В-клеток. Надо понимать, однако, что пептидная вакцина, в отличие от вакцины на основе аденовируса или мРНК, не может способствовать выработке цитотоксических Т-клеток (Т-киллеров, CD8+ Т-лимфоцитов), то есть речь идет только о Т-хелперах (CD4+), и прежде всего о тех, что активируют B-лимфоциты, производящие антитела.
К сожалению, об исследовании Т-клеточного ответа в статье ничего не сказано.
Об эпитопах и антителах
Важные технические подробности мы попросили прокомментировать Кирилла Скрипкина
. Кирилл — врач-биофизик, он внимательно отслеживает информацию, связанную с «ЭпиВакКороной», и его комментарии в соцсетях неизменно содержательны.
Кирилл, первый вопрос — о пептидах, которые использовались в вакцине. Среди моих знакомых вы первым нашли патент, где были названы эти участки:
S454-477,S1179-1200,S1189-1209. То есть один пептид из рецепторсвязывающего домена RBD субъединицы S1 и два перекрывающихся — из субъединицы S2. Эти пептиды включают описанные в других работах эпитопы, участки, с которыми могут связываться нейтрализующие антитела, напримерили. Это означает, что образование нейтрализующих антител к вакцине возможно?
У критиков этой вакцины есть разумное возражение, что эпитопы, описанные в статьях по ссылкам выше, относятся не к линейным эпитопам, а к конформационным. Следовательно, линейная аминокислотная последовательность из этого эпитопа в вакцинном пептиде не может вызвать образование нейтрализующих антител. Но авторы первой работы заявляют, что они картировали именно линейные эпитопы. Кроме того, по словам тех же авторов, антитела к конформационным эпитопам могут сохранять некоторую аффинность к линейным пептидам, составляющим эпитоп.
Другие два пептида: насколько можно понять из заявлений для широкой публики про «три линии защиты», антитела к ним должны помешать слиянию вируса с клеткой, поскольку субъединица
S2 отвечает за слияние. Это эффективно? Другие разработчики вакцин так делали? Ваше мнение, для чего выбрали перекрывающиеся пептиды?
Для ответа на первый вопрос нужно понять, что имеется в виду по словом «эффективно»? Efficacy, effectiveness или efficiency? (То есть снижение заболеваемости в вакцинированной группе людей по сравнению с невакцинированной в «идеальных» контролируемых условиях, например, в клинических исследованиях; то же в реальных условиях; или соотношение затрат и результата. — PCR.NEWS
.) Если efficacy, то по промежуточным результатам фазы 1-2 КИ можно сказать, что пока да, но нужно дождаться результатов третьей фазы. Об effectiveness можно будет узнать только из результатов гражданской вакцинации, если их раскроет Роспотребнадзор, а efficiency должен оценить планово-экономический отдел Минздрава.
По второму вопросу: разработчики пептидной вакцины COVAXX — UB-612 из Тайваня также пептиды из S2 субъединицы и N-белка в своей вакцине.
По третьему вопросу: я всегда верю в лучшее, поэтому считаю, что использование двух перекрывающихся пептидов с сайтом гликозилирования в них — это какой-то хитрый план. Хотя в новом патенте от Вектора только один пептид из S2 субъединицы: S1179-1209.
Авторы пишут, что выбрали пептиды, а не полноразмерный
S-белок, потому что опасались антителозависимого усиления инфекции. С другой стороны, в качестве носителя был выбранN-белок. А использование полноразмерногоN-белка в качестве носителя пептидов не может привести к АЗУИ? И кстати, АЗУИ при инфекцииSARS—CoV-2 вообще зарегистрировано?
Благодаря уважаемой Ольге Матвеевой мы знаем, что N-белок первого SARS вызывал ассоциированное с вакциной усиление инфекции у мышей (статьи и гг.). Достоверной информации о регистрации АЗУИ при инфекции SARS-CoV-2 на данный момент нет.
Иммуногенность определяли тремя способами: антитела к пептидам в составе вакцины, антитела к инактивированному вирусу
SARS—CoV-2 и антитела, нейтрализующие жизнеспособныйSARS—CoV-2. Отвечают ли эти эксперименты на вопрос, будут ли антитела, вызванные вакциной, взаимодействовать с реальным вирусом?
Да, в эксперименте по нейтрализации была показана способность вакцинных антител препятствовать проникновению жизнеспособного вируса SARS-CoV-2 в клетки Vero E6, которые несут на свей поверхности молекулы ACE2.
Сравнивать разные эксперименты по установлению нейтрализующей активности сложно, но давайте попытаемся. В фазе 3 клинических испытаний «Гам-Ковид-Вак» у 100 человек среднегеометрический титр нейтрализующих антител на 42-й день
, антитела у всех, кроме троих. В публикации «ЭпиВакКороны» — титры нейтрализующих антител после двух вакцинаций от 20 до 160, среднегеометрический титр 68 на 35-й день, сероконверсия у 100%. Методы и определение «титра нейтрализации» в этих работах различаются. Но хотя бы примерно, у кого титры больше?
Нет, сравнивать между собой результаты двух абсолютно разных методов нейтрализации совершенно неправильно. Соотносить друг с другом можно только результаты сравнения нейтрализующих титров антител у вакцинированных и рековалесцентов для обоих типов реакции нейтрализации. В Гамалеи такое сравнение провели, а вот в «Векторе» почему-то нет.
В то же время авторы подчеркивают, что защита от
COVID-19 возможна и при низких титрах. Также они отмечают, что в экспериментах на приматах нейтрализующие антитела появились, но исчезли за четыре недели до эксперимента по заражению обезьян вирусом, однако защитная эффективность была продемонстрирована. Говорится, чтоN-белок был выбран, поскольку в нем содержатся эпитопы клеточного иммунитета. Но при этом данных по клеточному иммунному ответу у участников КИ в статье нет. Что можно сказать по клеточному иммунитету, вызванному пептидной вакциной?
Как только исчезают плазматические клетки, которые нарабатывают нейтрализующие антитела, исчезают и сами эти антитела. Среднее время полужизни иммуноглобулинов G составляет 21 день. То есть нейтрализующие антитела у приматов были вновь наработаны клетками иммунологической памяти. Это можно было бы подтвердить, если бы у приматов определялся титр нейтрализующих антител после нагрузочного испытания, но авторы статьи об этом умалчивают. О клеточном иммунитете есть заявление уважаемого Александра Рыжикова: «Что касается клеточного иммунного ответа, он присутствует и сдвинут, как мы наблюдали на приматах также и у людей, в так называемый Th2-тип иммунного ответа, то есть гуморальный иммунитет доминирует. И клетки CD8 (цитотоксические лимфоциты) слабо индуцируются этим типом вакцин».
PCR.news наблюдает за развитием событий. Очевидно, в скором времени у нас будет больше информации.
Источник
А.Б.Рыжиков и соавт. // Простое слепое плацебо-контролируемое рандомизированное исследование безопасности, реактогенности и иммуногенности вакцины «ЭпиВакКорона» для профилактики COVID-19 на добровольцах в возрасте 18–60 лет (фаза I–II). // Инфекция и иммунитет. 2021, 11, 2; DOI: